奇点网
2022-06-06 20:30
运动可防癌。
2020年哈佛大学和NIH团队通过对75万人的大规模前瞻性研究发现[1], 每天运动1小时,可有效降低7种癌症的风险。此外,还有多个研究同样支持“运动防癌”这一观点[2, 3]。
运动或许也可以抗癌。
多个动物研究表明, 运动可调控机体免疫达到抗癌作用,如运动可通过诱导自然杀伤细胞促进肝癌和黑色素瘤小鼠模型的抗肿瘤免疫[4],以及通过调节血清代谢物在小鼠乳腺癌模型中促进CD8 T细胞的肿瘤杀伤作用[5]。
近日,来自 纽约大学格罗斯曼医学院的Dafna Bar-Sagi教授领衔的团队,在小鼠胰腺癌模型中再次发现了运动可以治疗癌症这一现象,他们发现 有氧运动可通过激活免疫系统,特别是IL-15Rα CD8 T细胞,抑制小鼠胰腺癌的生长 。
让人欣喜的是,他们还发现 运动的抑癌作用可以通过使用IL-15通路激动剂NIZ985来模拟。此外, 运动或NIZ985均可提高小鼠对免疫治疗(如PD-1抑制剂治疗)的反应性,这或可助力免疫治疗在胰腺癌的治疗中打开新的局面。
最重要的是,他们还在胰腺癌患者中初步证实了这一发现。相关研究发表于著名期刊 Cancer Cell 上[6]。

文章首页截图
为了评估有氧运动对胰腺肿瘤生长的影响,研究人员让 胰腺癌模型小鼠在跑台上进行低强度的有氧运动(5x /week,30 mins,15 cm/s)。
经过一段时间的锻炼(3-4周), 相比于对照组,实验组小鼠的胰腺癌体积缩小了20%到30%。
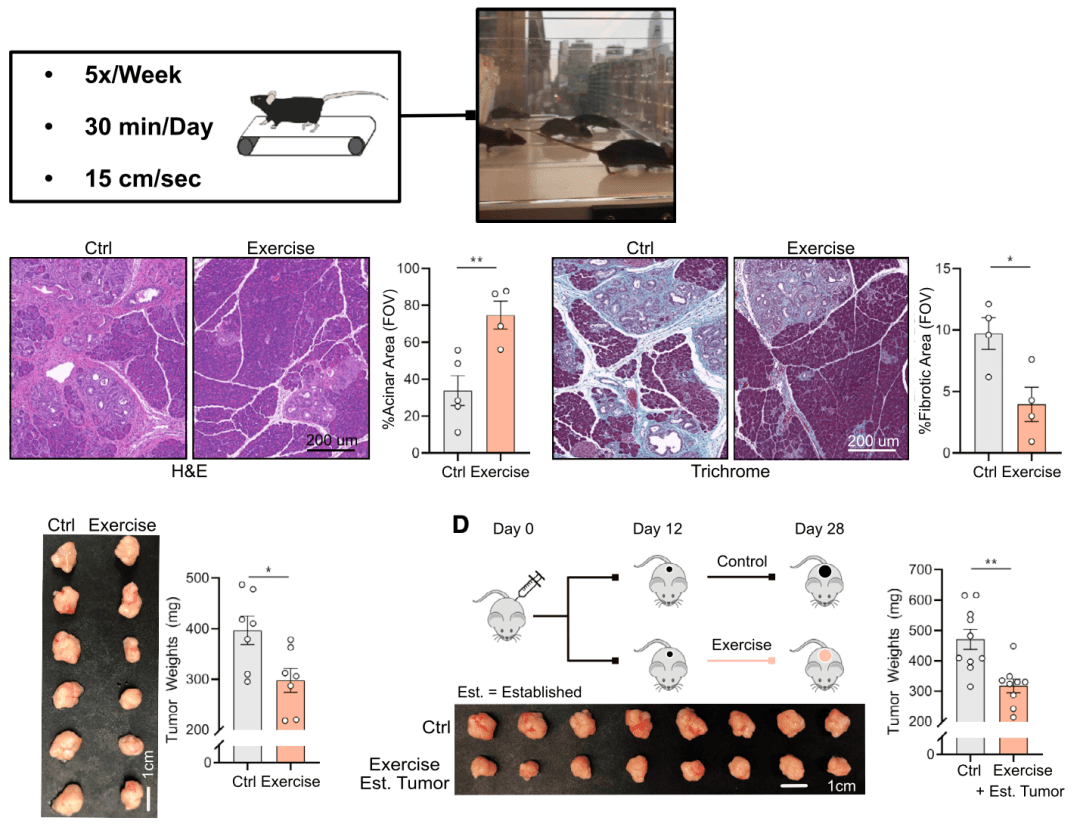
有氧运动使小鼠的胰腺癌体积缩小
接下来,研究人员通过对肿瘤组织进行单细胞RNA测序(scRNA-seq),试图揭开有氧运动抗肿瘤生长的机制。
由于先前多个研究显示,运动的抑瘤作用是通过免疫介导的[4, 5],研究人员首先对肿瘤组织中的免疫环境进行了分析。
分析结果显示,与对照组相比, 经有氧运动后,胰腺癌组织中淋巴细胞数量明显增加,尤其是CD8 T细胞,而髓系来源的免疫抑制细胞(MDSC)和中性粒细胞数量减少 。
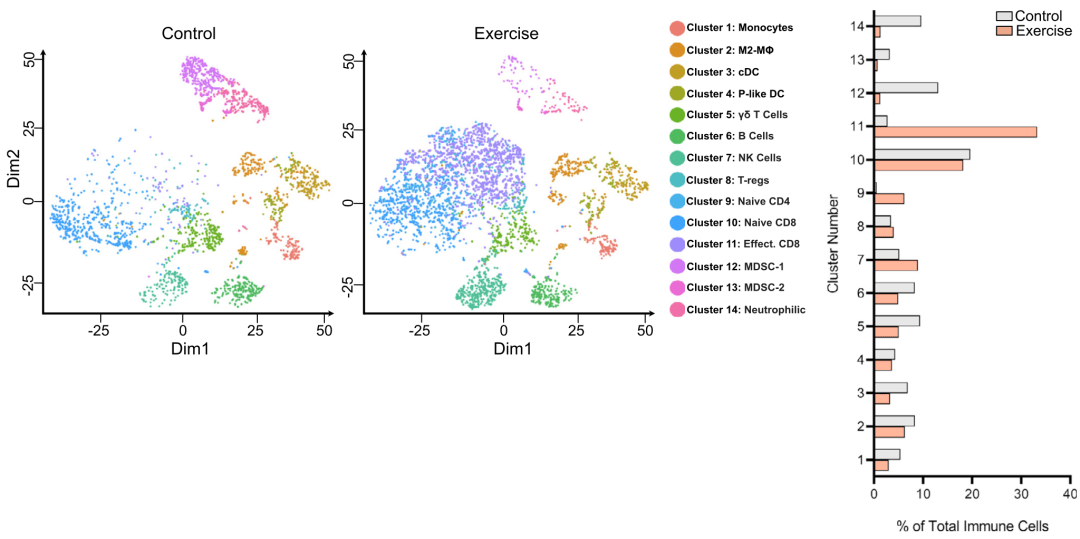
经有氧运动后,胰腺癌组织中淋巴细胞数量明显增加,尤其是CD8 T细胞
进一步分析scRNA-seq数据发现,有氧运动降低了髓系细胞 Cxcr2 和 Csf3r 基因的表达水平 (mRNA降低),并降低了体内MDSC上CXCR2蛋白的表达。
同时,他们还发现, 从运动后小鼠肿瘤中分离出的MDSC,在体外对T细胞激活的抑制作用显著降低。
这些结果表明, 运动重塑了胰腺癌小鼠的免疫状态,减少了肿瘤组织中的MDSC,在一定程度上逆转了MDSC对T细胞抑制功能。
随后,研究人员又分析了肿瘤组织中T细胞的scRNA-seq数据,发现 运动后肿瘤组织中T细胞比例的增加,几乎完全是由效应CD8 T细胞数量增加所致 。
这一结果与通过免疫荧光对运动后肿瘤中浸润性CD8 T细胞数量的检测结果相一致。
运动后肿瘤组织中效应CD8 T细胞数量显著增加
紧接着,研究人员 在一项前瞻性临床试验中,探究了运动干预是否可以在人类中调节机体抗肿瘤免疫。与小鼠的结果相一致, 与匹配的历史对照组相比,手术前参加锻炼的胰腺癌患者肿瘤组织中,有显著更多的CD8 T细胞浸润和颗粒酶B (GZMB,强有力的细胞免疫杀伤因子)表达。
此外, 在参加锻炼的队列中,肿瘤组织中CD8或GZMB表达水平高的患者的中位总生存期显著延长,而在对照组中未发现与CD8或GZMB状态有关的患者生存上差异。
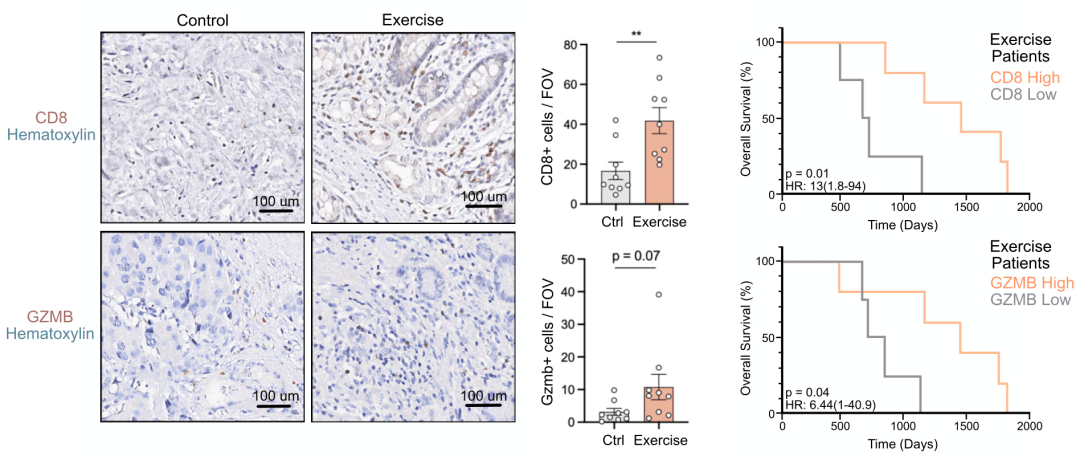
手术前参加锻炼的胰腺癌患者肿瘤组织中有显著更多的CD8 T细胞浸润量和GZMB表达,且CD8或GZMB表达水平高的患者的中位总生存期显著延长
这些结果表明, 运动同样可在人胰腺癌患者中诱导肿瘤浸润CD8 T细胞增加,并增强其抗癌功能 。
为了研究运动后小鼠CD8 T细胞激活的机制,研究人员重点研究了IL-6、IL-8和IL-15这三种介导运动后代谢和免疫反应的肌细胞因子,发现 IL-15是运动后肿瘤浸润性CD8 T细胞增加的上游调节因子,运动后小鼠肿瘤组织中IL-15Rα CD8 T细胞的比例和数量均显著增加 。
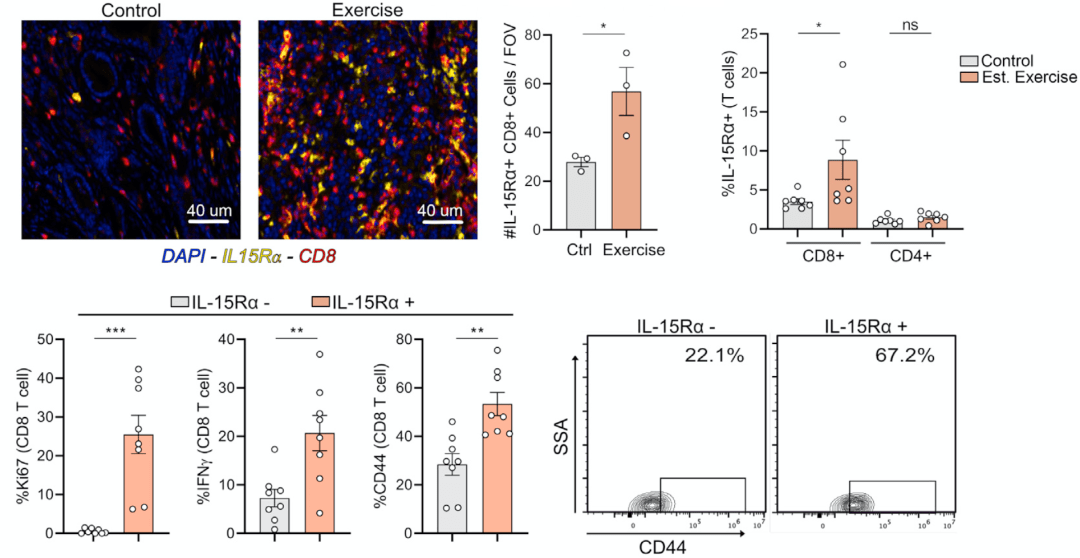
IL-15是运动后肿瘤浸润性CD8 T细胞增加的上游调节因子
在小鼠体内 阻断了IL-15信号后,运动所介导的IL-15Rα CD8 T细胞浸润增加和抗肿瘤效果大大减弱 ,这证明了IL-15/IL15Rα轴具有在运动后促进抗肿瘤免疫方面的作用。
在临床研究中,胰腺癌患者对免疫检查点抑制剂治疗的反应不佳,而运动后CD8 T细胞被激活,这意味着 运动很有可能可以增强免疫检查点抑制剂治疗的疗效。
结果不出所料,在模式小鼠身上,研究人员发现运动和PD-1抑制剂的联合比PD-1抑制剂单一疗法更有效地抑制了肿瘤的生长,显示出运动疗法对胰腺癌PD-1抑制剂治疗的增敏作用。
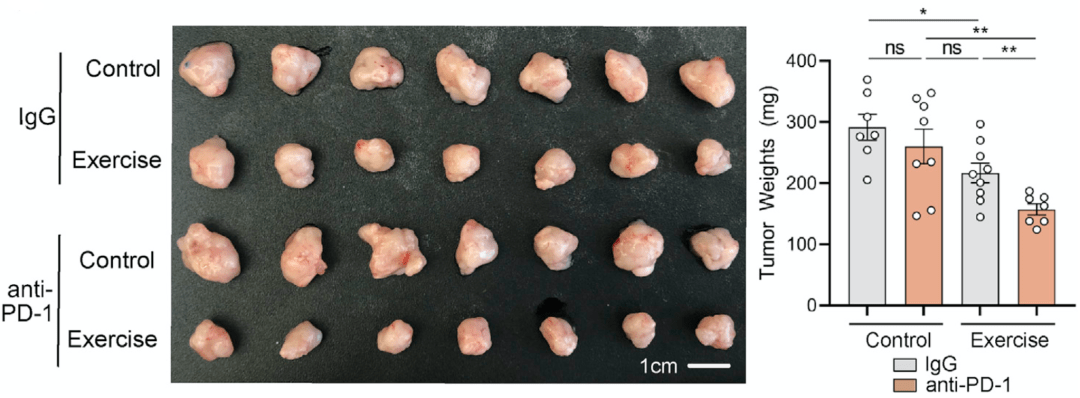
运动疗法对胰腺癌抗PD-1治疗的增敏作用
既然IL-15/IL-15R是介导胰腺癌中运动后激活免疫系统和抗癌作用的关键,那么直接使用IL-15轴的激动剂 (NIZ985,IL-15和IL-15Rα的异源二聚体)是否也可起到同样的作用呢?
研究结果发现,对胰腺癌小鼠 使用NIZ985后,同样可增加肿瘤中CD8 T细胞和GZMB CD8 T细胞的数目,可显著延长胰腺癌小鼠的生存期(40%) 。
且 IL-15轴的激动剂与PD-1抑制剂的联合使用,相比于任何一种单一疗法,均更显著地抑制了小鼠胰腺癌的生长,显著延长了小鼠的生存时间。
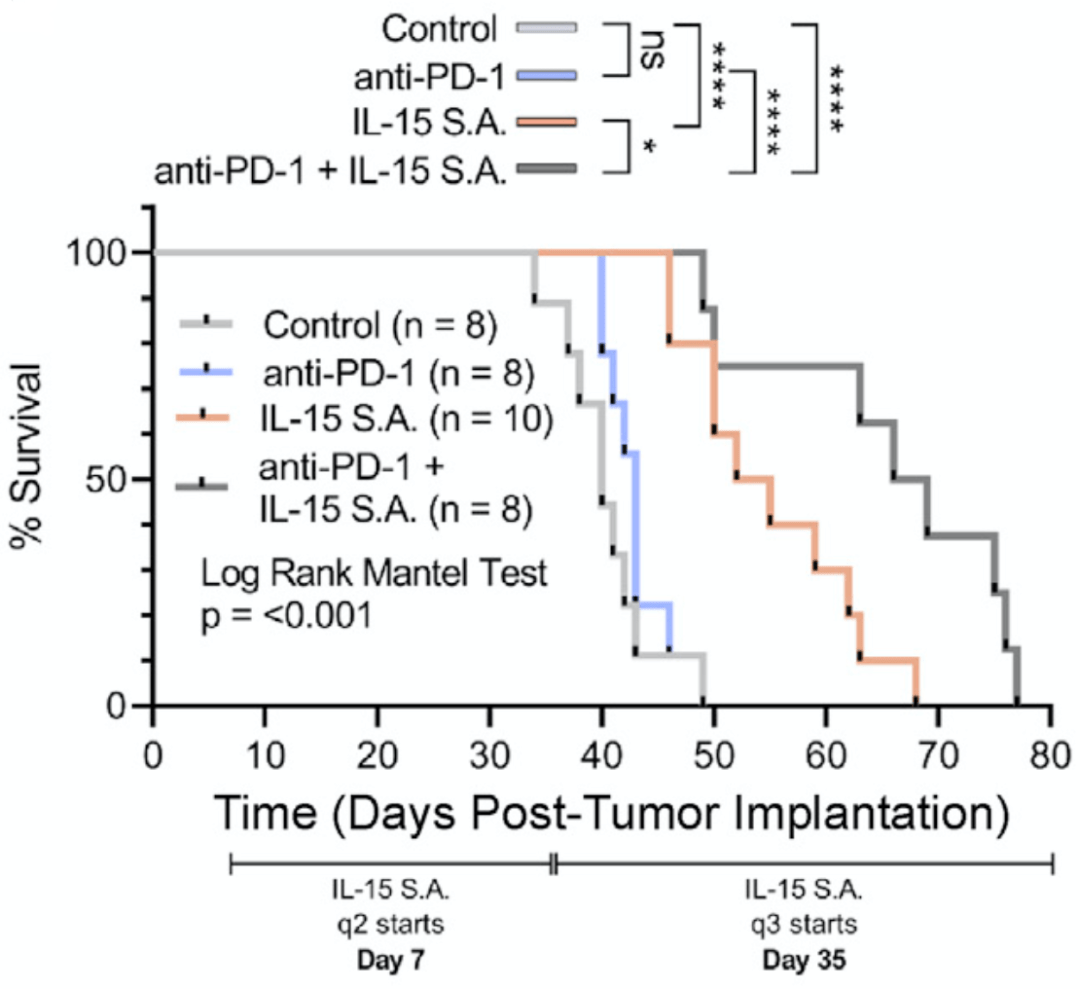
IL-15轴的激动剂与抗PD-1治疗的联合,相比于任何一种单一疗法,显著延长了小鼠的生存时间
由于目前胰腺癌患者的治疗主要以化疗为主 (吉西他滨 Nab-紫杉醇,GEM/ABX),研究人员还探究了IL-15轴的激动剂与化疗药物联合能否起到“强强联合”的作用。
研究结果发现,与任何一种单一疗法相比, GEM/ABX IL-15轴的激动剂联合在抑制肿瘤生长方面更有效,显示出了这一联合疗法的临床转化潜力。

与任何一种单一疗法相比,GEM/ABX IL-15轴的激动剂联合在抑制肿瘤生长方面更有效
总的来说,本研究再次证实了运动可治癌。在胰腺癌中,运动可通过激活IL-15/IL-15Rα轴介导抗肿瘤效果,且该作用可通过使用IL-15轴激动剂进行模拟。
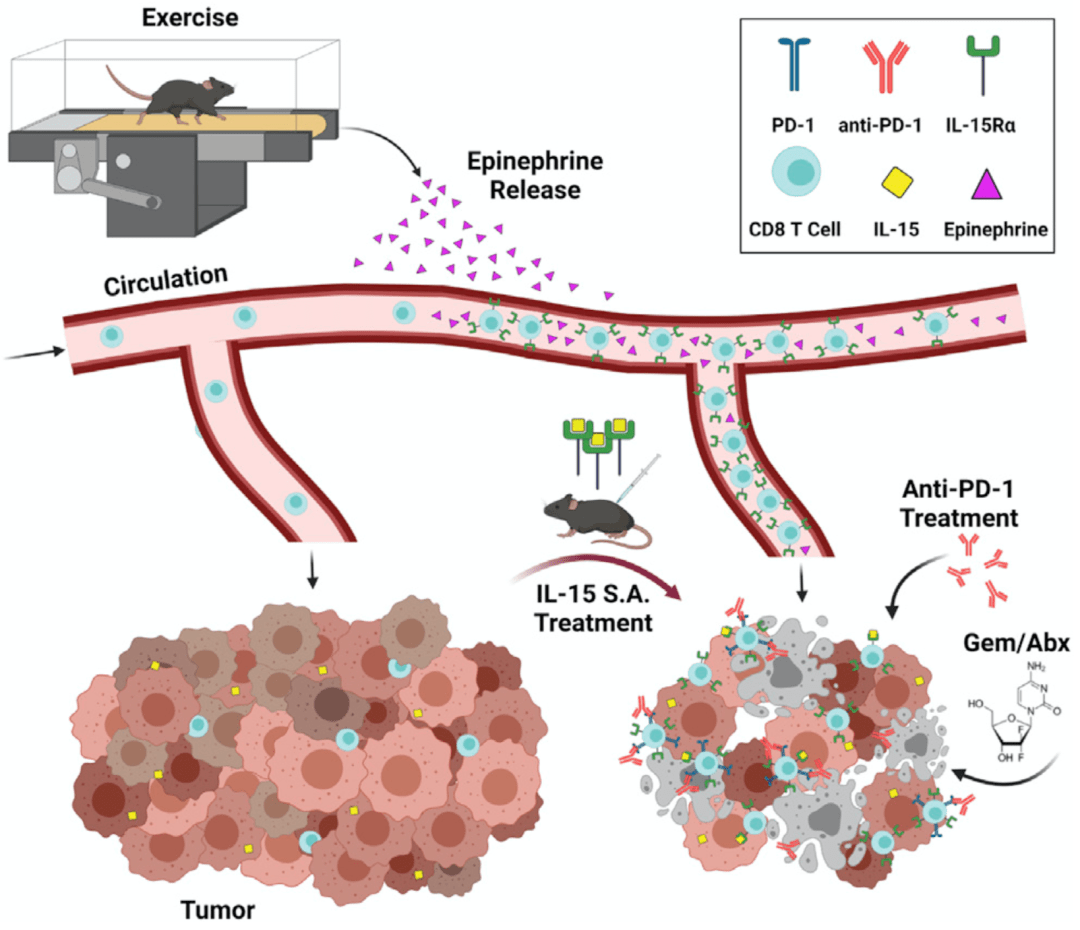
机制示意图
IL-15轴激动剂在临床中与免疫检查点抑制剂及标准化疗方案联用,有较大的增强抗癌作用潜力,为胰腺癌的治疗带来一线曙光。
参考文献
1.Matthews CE, Moore SC, Arem H, Cook MB, Trabert B, Hakansson N, Larsson SC, Wolk A, Gapstur SM, Lynch BM et al: Amount and Intensity of Leisure-Time Physical Activity and Lower Cancer Risk. J Clin Oncol 2020, 38(7):686-697.
2.Arfianti A, Pok S, Barn V, Haigh WG, Yeh MM, Ioannou GN, Teoh NC, Farrell GC: Exercise retards hepatocarcinogenesis in obese mice independently of weight control. J Hepatol 2020, 73(1):140-148.
3.Weitzer J, Castano-Vinyals G, Aragones N, Gomez-Acebo I, Guevara M, Amiano P, Martin V, Molina-Barcelo A, Alguacil J, Moreno V et al: Effect of time of day of recreational and household physical activity on prostate and breast cancer risk (MCC-Spain study). Int J Cancer 2021, 148(6):1360-1371.
4.Pedersen L, Idorn M, Olofsson GH, Lauenborg B, Nookaew I, Hansen RH, Johannesen HH, Becker JC, Pedersen KS, Dethlefsen C et al: Voluntary Running Suppresses Tumor Growth through Epinephrine- and IL-6-Dependent NK Cell Mobilization and Redistribution. Cell Metab 2016, 23(3):554-562.
5.Rundqvist H, Velica P, Barbieri L, Gameiro PA, Bargiela D, Gojkovic M, Mijwel S, Reitzner SM, Wulliman D, Ahlstedt E et al: Cytotoxic T-cells mediate exercise-induced reductions in tumor growth. Elife 2020, 9.
6.Kurz E, Hirsch CA, Dalton T, Shadaloey SA, Khodadadi-Jamayran A, Miller G, Pareek S, Rajaei H, Mohindroo C, Baydogan S et al: Exercise-induced engagement of the IL-15/IL-15Rα axis promotes anti-tumor immunity in pancreatic cancer. Cancer Cell 2022.
声明:该文观点仅代表作者本人,搜狐号系信息发布平台,搜狐仅提供信息存储空间服务。
华人团队发现肠道细菌代谢物通过促进神经细胞凋亡,导致认知功能障碍
来源:生物世界 2022-06-08 09:45
这项研究为脑肠轴增加了新的证据,也提示了肠道菌群在年龄相关的认知能力下降中的重要作用,此外,该研究还提出了相应的解决方案。
人类和其他哺乳动物一样,身体被包括细菌、病毒和真菌在内的数万亿微生物占据,这些微生物被统称为共生菌群。从某种意义上来说,“人”是一个由人体和共生菌群的多元复合体。
人体肠道内寄生着大量微生物,这些肠道微生物群,影响着人类肥胖、肠炎、自身免疫疾病、对癌症治疗药物的反应,甚至影响人类寿命等等。越来越多的证据揭示了人类与这些肠道微生物群之间的相互依赖程度,也强调了脑肠轴的重要性。
近日,美国路易斯维尔大学 Zhang Huangge 和 Teng Yun 等人在 Cell 子刊 Cell Host & Microbe 发表了题为:Gut bacterial isoamylamine promotes age-related cognitive dysfunction by promoting microglial cell death 的研究论文。

该研究发现,肠道细菌产生的代谢物异戊胺(isoamylamine,IAA)会促进神经细胞小胶质细胞的死亡,从而导致认知能力下降。
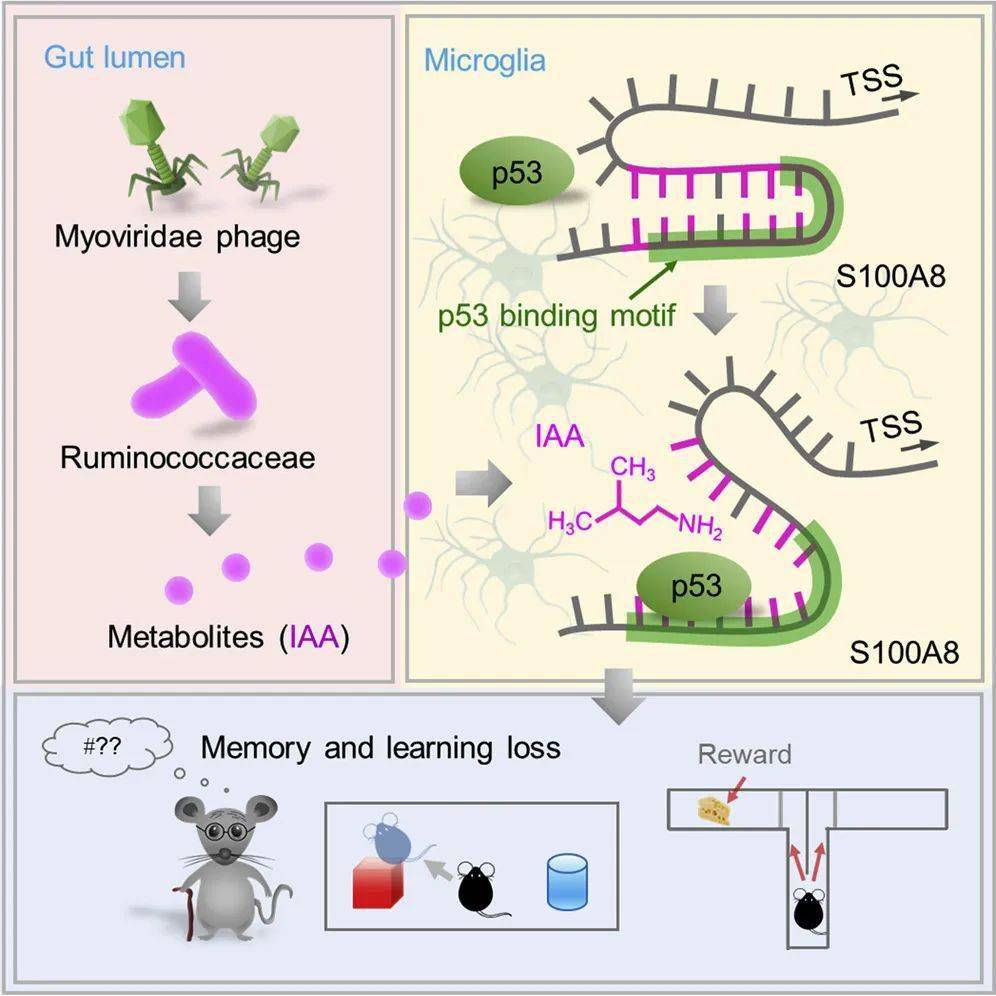
之前已有研究表明,肠道细菌与大脑健康之间存在着密切联系。在这项最新研究中,研究人员探索了肠道中的一个细菌家族瘤胃球菌科(Ruminococcaceae)产生的一种代谢物异戊胺(isoamylamine,IAA)对大脑的可能影响。
研究团队首先发现,随着年龄的增长,小鼠和人类的瘤胃球菌科噬菌体减少,瘤胃球菌科细菌富集,导致异戊胺(IAA)随之增多,而 IAA 可以穿越血脑屏障(BBB)进入大脑细胞。给年轻小鼠口服 IAA 会导致它们认知能力下降,瘤胃球菌科噬菌体则能够降低其 IAA 水平。
从机制上来说,研究团队发现,IAA 通过将转录调节因子 p53 招募到负责感知和响应衰老的 S100A8 基因的启动子区域,促进其表达,从而促进小胶质细胞的凋亡。具体而言,IAA 识别并结合 S100A8 基因的启动子区域以促进其自身互补发夹结构的展开,从而随后使 p53 能够访问 S100A8 启动子并增强 S100A8 表达。
接下来,研究团队使用 Oligo-S100p1-G 阻断 IAA 介导的 S100A8 基因的激活,结果显示,这能够延缓老年小鼠的认知能力下降。
总的来说,这项研究表明,肠道微生物释放的代谢物能够通过与基因组 DNA 的直接结合,并招募转录因子,作为转录辅助调节剂调控基因表达。该研究还详细解析了瘤胃球菌科的代谢产物 IAA 通过这种调控机制调控大脑中 S100A8 基因的表达,导致小胶质细胞凋亡,从而促进认知能力的下降。
这项研究为脑肠轴增加了新的证据,也提示了肠道菌群在年龄相关的认知能力下降中的重要作用,此外,该研究还提出了相应的解决方案。研究团队表示,还需要进一步的研究来确定人类肠道菌群中的 IAA 是否也会导致认知能力下降,如果同样如此,抑制 IAA 的产生有望用于延缓或阻止年龄相关的认知能力下降。
![SiS001! Board - [第一会所 关闭注册]](images/green001/logo.png)



